众所周知,医疗器械临床评价可以通过多条路径,如上图所示。不同类型及不同风险等级的医疗器械临床评价路径的选择,常常困扰着众多的注册人员或申办者。在我们的工作中,较多注册申请企业对于创新医疗器械是否必须通过境内临床试验才能获批上市存在疑问。在此,我们特推出本次解惑篇,希望能为您的决策提供有价值的参考。
根据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查需满足以下条件:(一)知识产权;(二)基本定型;(三)首创及显著价值。
那么,问题来了。
“创新医疗器械既拥有核心技术发明专利权,其主要原理或作用机理又为国内首创,不进行境内临床试验可行吗?”
答案,是肯定的。
成功案例
从国家药品监督管理局医疗器械技术审评中心(CMDE)公开的审评报告中,我们可以看到已有不少创新医疗器械通过非境内临床试验数据成功注册的先例。以下是我们汇总的通过非境内临床试验数据获批的创新医疗器械列表。
同品种比对路径(CER)获批的创新医疗器械:
同品种比对路径(CER)结合其他路径获批的创新医疗器械:
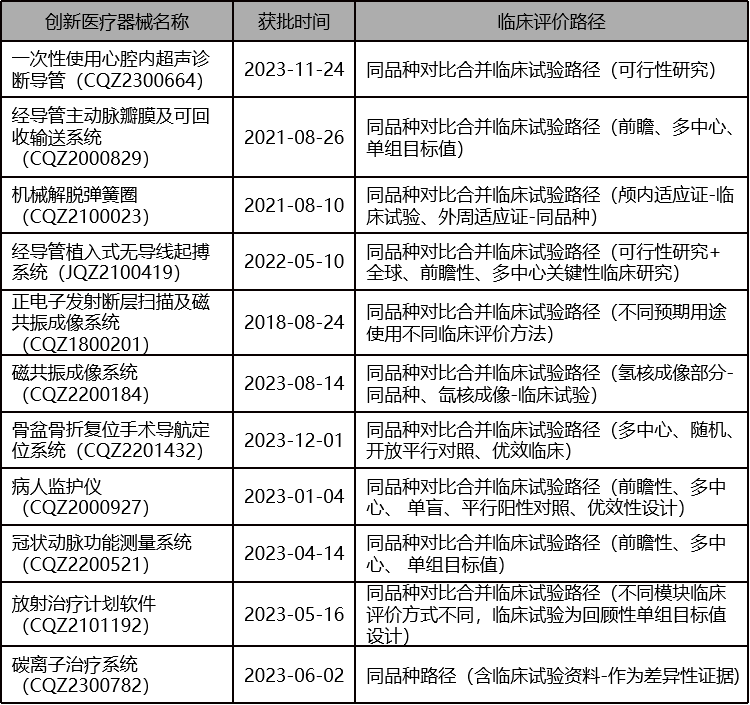
接受境外临床试验数据路径获批的创新医疗器械:
是否有些出乎意料?这些都是经过实践检验并取得成功的实例。原来这么多创新医疗器械没有进行境内临床试验,且相当一部分仅通过同品种比对方式获批。
这些案例给我们提供了宝贵的经验:即使是创新医疗器械,在选择临床评价路径时,切勿一刀切,而是需要根据产品特征、临床风险、已有临床数据等情况进行全方位考量。
创新医疗器械决策临床评价路径关键点:
创新医疗器械采用非临床试验路径进行申报的难点在于如何论证其创新点的安全性和有效性。关键点在于:
· 产品的创新性:产品的创新程度越高,选择同品种比对路径的可能性越低。
· 产品的临床风险:产品的临床风险越高,需要进行更充分的临床评价,如开展临床试验。
若具有以下情况,创新医疗器械可以考虑同品种比对或同品种结合临床试验或境外临床试验路径:
· 有前代产品或相似度高的同类产品:差异性可通过非临床试验数据论证安全有效性,比如性能确认、性能比对、性能验证、生物学评价、模体试验、计算机模拟试验、动物试验等方式;或结合可行性临床研究或临床试验数据论证申报产品可达到其预期性能且风险可接受。
· 有境外临床试验数据:申报产品具有境外临床试验数据,且符合《接受医疗器械境外临床试验数据技术指导原则》,申请人可按照接受境外临床试验数据路径进行注册申报。
小结
在制定临床评价路径时,需对目标产品进行深入剖析,结合产品特性、临床风险及已有临床数据等关键因素,灵活选择最合适的临床评价路径或者路径的组合,以确保医疗器械的安全性和有效性得到充分验证。
若存在前代产品或相似度高的同类产品,或申报产品有境外临床试验数据,且已有数据较为充足,建议优先考虑采用同品种或多种路径相结合进行临床评价。同时,申请人应充分发挥创新医疗器械的流程优势,积极与监管部门沟通协作,在确保标准不降低、安全有保障的前提下,充分利用已有数据资源,选择最为有效的临床评价路径,以减轻企业负担,加速创新医疗器械的上市进程,从而造福更多患者。
具体创新医疗器械的案例分析敬请关注我们的下一期介绍,我司具有丰富的临床试验、同品种临床评价和注册经验。无论您在临床评价策略选择还是具体执行过程中遇到困惑,欢迎随时交流和探讨。您可以扫描以下二维码与我们取得联系,我们将竭诚为您提供专业、高效的解决方案。
凌仕医疗
凌仕医疗(LINKS CRO) 是一家专注于创新、高风险、植(介)入医疗器械临床试验的CRO公司,为企业在医疗器械研发过程中提供全过程、一站式的临床试验解决方案。LINKS总部位于上海,下设北、上、广、深分公司及十个办事处。现有员工近200人,其中技术人员超85%,分布于全国近30个城市。
主要业务范围:CRO服务、SMO服务、CER服务、稽查服务、上市后研究、海内外注册、核心实验室、创新申报、国家局答辩辅导、海外企业代理人服务等。
主要治疗领域:心脏领域、神经血管领域、外周血管领域、手术系统领域、肿瘤、眼科、医疗美容,以及其他领域如骨科等,每年提供近300个项目咨询/顾问服务。
